医疗器械电气安全GB9706.1-2020标准升级如何申请许可事项变更?
2023-02-20 13:44:52进口医疗器械电气安全9706.1-2020标准升级如何申请许可事项变更?
【摘要】:进口医疗器械超声刀电气安全9706.1-2020标准升级如何申请许可事项变更?众所周知国家标准化管理委员会在2020年发布了修订后GB 9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》标准,并将于2023年5月1日开始正式实施。这意味着以前已经注册完成的产品,必须按照GB 9706.1-2020重新送检,并申请医疗器械许可事项变更。特别是注册证即将到期的企业,更是需要在延续注册申请前完成许可事项变更。据小编了解到很多进口医疗器械代理人还没有完成相关工作,甚至因为标准升级不得不放弃部分销量差的产品,原因何在呢,下面小编给大家介绍一下。

【暂未完成标准升级和许可变革的原因】
1:费用原因:大家都知道,进口医疗器械注册需要缴纳一笔审评审批费用,以许可事项变更为例,受理之后就要缴纳50400元的变更注册费。另外GB9706.1于2023年5月1日实施,同时YY0505也要于2023年5月1日实施,因此2个标准需要一起送检,检测费用也要3万元起步。加上很多企业自己根本没有人员和能力完成许可事项变更,还要委托注册代理机构,又要多花费一些代理费用。以减少项目失败的风险。因此标准升级导致每款产品要花费10万元左右的一笔额外费用。很多企业拥有的注册证不止1个,多的甚至十个以上,就要多花费将近百万,对企业来说是不小的负担。
2:时间原因:因为企业集中要集中送检9706.1和YY0505标准升级检验,导致检验机构拥有大量的咨询和排单,这种拥挤性送检导致仅仅是排队就要2-3个月不等,甚至要更久。企业送检之后只能等待,时间不可控制。
3. 技术原因:有很多大型的设备,由于体积较大,组装困难,工作环境苛刻,因此需要特殊的检测室,甚至需要检测人员和设备到企业来进行检测,这对检测所本来就不充足的人员和检测硬件资源来讲,更是雪上加霜,很难完成相关工作安排。
4:疫情原因:因为疫情原因,2020-2022年企业很难完成送检或检测任务,因此导致时间浪费了很多。不是企业这边封控,就是检验机构那边封控,各种原因无法良好的沟通和检验,导致检验进度十分缓慢。
总结:种种原因导致很多进口企业并未完成9706.1的标准升级,那么该如何应对呢,下面小编来给大家讲解一些思路。
【解决思路】
1. 节约费用:既然标准升级不可避免,那么企业只有2个选择,1.放弃该品种在国内的销售;2.尽快完成标准升级;对于第一种选择,我们已经有部分客户不再延续部分品种,至于经销商坚持要做的品种,费用由经销商来全部承担或部分承担,这样可以节约标准升级的费用。对于第二种选择,既然一定要花这个钱,就要花的实在,目前检测所的检测费用差距还是很大的,企业可以选择费用较低的检测机构或第三方检测机构完成检测。另外企业还可以选择费用较低的注册代理机构,也可以省下一笔服务费用。检测费用和注册代理费用至少可以省下2-3万。减少企业的负担。
2. 节约时间:对于需要尽快完成标准升级的企业,节省时间也是很重要的,因为注册证一共5年有效期,不少企业面临着延续注册的情况;目前国家相关法规规定在延续注册时是不能同时完成标准升级的,因此在延续注册之前要尽可能完成9706.1的标准升级,这样才能顺利的完成延续注册。因此企业可以选择进度较快的检测所或第三方检测机构完成检测,目前国家局已经开放认可部分第三方检测机构的报告,这些检测机构大多数是私营企业,流程比较简化,效率有所提高,可以减少不少排队检测和检测过程的时间。另外也可以选择效率较高的注册代理机构,也可以剩下一些服务时间。
3. 提高成功率:标准升级和许可事项变更需要专业的人员和了解注册法规的办事人员,因此如果要委托注册代理机构完成注册,稳定的、经验丰富的注册专员不可或缺,可以提高注册成功率,避免很多麻烦。
【检测标准、检测时间、费用简介】
|
检测标准 |
检测机构 |
排队时间 |
检测时间 |
检测费用 |
|
GB9706.1-2020 |
其他检测机构(可能报告无法直接使用) |
约3个月
|
约3个月 |
3万左右起步 |
|
YY9706.102-2021 |
其他检测机构(可能报告无法直接使用) |
1.5万左右起步 |
||
|
GB9706.1-2020 |
国家级CMA资质检测机构 |
约1.5个月 |
约1.5个月 |
2万左右起步 |
|
YY9706.102-2021 |
国家级CMA资质检测机构 |
1万左右起步 |
【9706.1标准升级许可事项变更办事指南】
【基本信息】
办理事项:进口医疗器械许可事项变更申请(技术要求强制性标准升级)
法定办理时限:188个工作日
主管部门:国家药品监督管理局
办理结果:《医疗器械注册证变更批件》、《产品技术要求变更对比表》
证书有效期:5年
【受理条件】申请事项属于国家药品监督管理机职权范围,申报资料齐全、符合形式审查要求。
【办理流程和办理时限】
检测:3-6个月
准备资料:1个月
受理:5个工作日
审评:技术审评机构应当在60个工作日内完成第二类医疗器械注册的技术审评工作,应当在90个工作日内完成第三类医疗器械注册的技术审评工作。
许可决定:20个工作日;
送达:10个工作日。
【办理地点】
北京市西城区宣武门西大街28号大成广场3门一层 国家药品监督管理局行政受理服务大厅4-7号窗口
【咨询方式】
(一)窗口咨询;
(二)电话咨询;
(三)信函咨询。
咨询部门:国家药品监督管理局行政受理服务大厅
通讯地址:北京市西城区宣武门西大街28号大成广场3门一层
邮政编码:100053
联系电话:010-88331776(周三、周四全天)
【申请材料】:
1.申请表
2.证明性文件
3.注册人关于变更情况的声明
4.原医疗器械注册证及其附件复印件、历次医疗器械注册变更文件复印件
5.变更申请项目申报资料要求
6.与产品变化相关的安全风险管理报告
7.变化部分对产品安全性、有效性影响的资料
8.针对产品技术要求变化部分的注册检验报告
9.符合性声明
【法规依据】《医疗器械监督管理条例》(国务院令第680号)第十四条:“已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;”
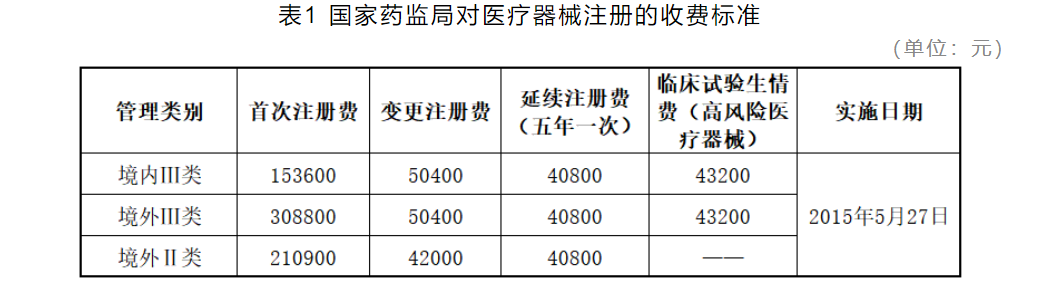
【官方收费标准】50400元/注册单元
收费依据:国家发展改革委《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》(财税〔2015〕2号)和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》(发改价格〔2015〕1006号),《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告》(2015年第53号)。
【常见问题】进口产品提交申报资料有哪些要求?
答:依据《境内第三类和进口医疗器械注册审批操作规范》(食药监械管[2014]208号)的要求,进口产品申报资料,如无特别说明,原文资料均应由申请人签章,中文资料由代理人签章。原文资料“签章”是指:申请人法定代表人或者负责人签名,或者签名并加盖组织机构印章,并且应当提交由申请人所在地公证机构出具的公证件。
【结语】企业请注意:GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》新标准,以前已注册的产品,必须要按GB9706.1-2020 重新送检,以及医疗器械产品注册证快到期的企业,也需要提前规划好时间按照GB9706.1-2020送检。请各位朋友提前送检,以免产品不符合标准被查影响停产,无法销售。

